 碳还会带来新的惊喜吗?
碳还会带来新的惊喜吗?
-兼谈碳有多少同素异形体
早年人们认为碳的同素异形(性)体只有石墨和金刚石,然而近30年来,人造金刚石、零维富勒烯、一维纳米碳管以及二维石墨烯这些新的碳同素异形体的发现、获得以及各自特殊性能的研究给我们带来不断的惊喜,碳元素多次成为“明星分子”。碳还能继续带来新的惊喜吗? 其实,胡盛志老师在他的博文“从球碳C60到石墨烯: 会有下一个碳明星分子吗?”一文中就经已做了很好的答复。碳元素完全有可能再次成为“明星分子”,也将给我们带来更多的惊喜,其原因就在于碳有无穷无尽的同素异形体,而其中大多数我们现在都还没得到,其性能更是不很清楚,新的碳同素异形体的研究和开发,就完全有可能给我们再次带来新的惊喜。
碳为什么能形成同素异形体?
我们知道,碳的原子序数为六,共有6个电子。碳原子在基态时,其电子在能量从低到高的电子层内配置为:第一层的1s2有两个核心电子;第二层的2s2和2p2有4个更弱的能成键的电子,被称为价电子,它们在形成碳单体和化合物的价键中起重要作用。绝大多数情况下,碳原子2s电子亚层中的一个电子可受激发跳到2p电子亚层的一个空轨道中。这样就形成2s和2px 、2py和2pz四个能成键的价电子。然而,这4个轨道在不同情况下又会相互混杂成杂化原子轨道。在sp杂化时,碳原子2s的一个轨道只和2p的一个轨道,例如2px进行杂化形成sp杂化轨道,它们在键合时形成两个σ键,而剩下的2py和2pz,则会形成2个π键。碳原子以σ键结合时,两原子间的电子云在轨道的长轴方向结合,即形成头对头的叠合;而以π键结合时,则在轨道的长轴方向平行靠拢,即成为肩并肩的叠合。在sp2杂化时,碳原子2s的一个轨道和2p的两个轨道,例如2px和2py进行杂化形成sp2杂化轨道,形成3个σ键,而剩下的2pz,则会形成一个π键;而在sp3杂化时,碳原子2s的一个轨道和2p的全部3个轨道杂化,形成4个σ键。π轨道的π电子在碳材料中起着独特的作用,σ电子可说是形成物质的骨架基础,而π电子则是发挥物质功能的根源。这点以后将专文介绍。
总之,碳原子的6个电子中能成键的4个电子,随其占有轨道的不同组合,在碳原子相互结合或与其他原子形成化合物时,基本上可以产生三种不同的化学键,即单键、双键和三键。包括地球在内的宇宙时空内有丰富的碳单质和碳的各种化合物,它们都是这些杂化碳原子的产物。
碳与同在周期表中笫四族的硅和锗不同,它除了内部有1s2轨道、只含两个核心电子外再没有其它内部轨道,因此可以形成包括sp在内的、n=1-3的三种spn杂化。硅和锗的原子序数更大,电子层更多,受内层其它内部轨道所影响,只能形成sp3杂化而没有sp2和sp杂化,它们也只能形成sp3杂化的一种立方固体基态,由于它们的结合半径比碳原子更大而不能形成稳定的双键。这也正是硅和锗不能像碳那样,形成大量有机化合物和众多同素异性体的原因。比碳原子结合半径更小的氮和氧等有可能形成多重键,但它们能成键的价电子数少,这就意味着可形成的结构数少。因此,周期表的所有元素中唯一只有碳是能形成更多价键的原子,也只有碳元素才能形成更多的结构,是能有更多变化和更多同素异形体的元素。正是由于在原子间有独特的链接能力,使得碳原子能形成链,环和网状等各种各样的结构。
Heimann等德、俄、日的3位学者于1997年共同将各种已被证实、假设和推理可能存在的各种碳的同素异形体总包在一平面三角形的碳键杂化图中(图1)。三角形顶点分别代表sp3、sp2和sp杂化碳原子单独形成的所谓“原型”(archetypical)同素异性体:金刚石、石墨和炔碳。而三角形边线则由被看作是由spn 组成(1﹤n﹤3) 的包括各种中间形态的碳,在三角形内部则为具有不同程度三种杂化碳原子混合形成的各种无定形碳。 例如,各种富勒烯和碳纳米管都位于sp3-sp2三角线上,随五员环(P)和六员环(H) 的环数比不同,各种富勒烯位于该线的不同位置。P/H=0相当于纯石墨,而P/H=∞时则相应于全五员环的碳簇C20。理论上C20是一种类金刚石的富勒烯,由于违反了隔离五员环的规则,它很不稳定,易崩裂成金刚石结构,用激光蒸发源选择产生C20附近大小分布的碳簇时,就可形成几乎是纯sp3杂化碳原子的类金刚石碳。C60的P/H=0.6,而其杂化程度相当于Sp2.28。
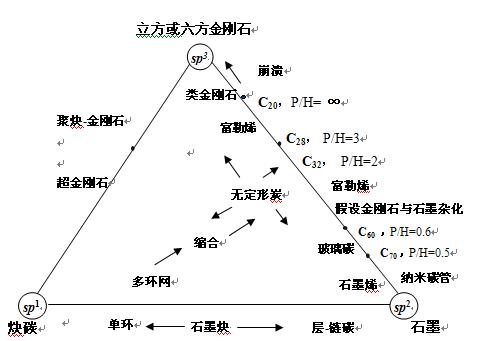
图1.碳同素异性体的平面三角形“相”图
杂化程度为1﹤n﹤2的碳,包括近年来通过不同方法合成的单环环状(N)碳,其环中碳原子数N=18、24、30…等处于sp-sp2连线上。由sp2形成的六员碳环被n的-C≡C-连接键合而成的石墨炔(Graphynes)也在这一边线上。笫三边sp-sp3线上的碳是目前了解得最少的部分。例如石墨通过冲击波转变成金刚石时短暂呈现的一种相,相应于所谓一维超级金刚石的假设结构-聚炔-金刚石,被认为是由皱折的类金刚石层组成,其中稠密的碳环呈发状构型、被垂直于层面短的sp型碳链连接在一起。在这一边线上还可能存在3D-超级金刚石晶格碳。
位于三角形内部的碳是以各种方式结合, 由三种杂化形式以不同比例混合而成。例如各种无定形碳和玻璃碳等,它们的结构十分复杂,可能拼合有任意分布的、中间杂化态的结构单元,其结构和数量随合成的方法和条件而定。在这一区域内还可能包括更复杂的由混合和中间态结构两种单元组成的碳。从这一图可以看出,其中大多数的碳我们现在都还没能得到,其性能更是不很清楚,这方面的研究还有极大的空间,很可能会带来一些意想不到的结果。
在上面的三角形碳键杂化图中,因为只谈及碳的同素异形体,所以完全没有考虑氢原子的存在。由有机物热处理转化成的大量炭材料,以及由化学气相沉积(CVD)法形成的类金刚石薄膜等,都还含有微量的氢原子,其C/H比多在10以上,因此我们考虑:如果加上氢原子在碳氢化合物中的作用,就可以在原来仅有碳的平面三角形图中加上氢原子对C/H的影响(图中各烃类后的数字为碳氢原子数比),从而可形成如图2的正四面体图。图中含有不同微量氢的各种炭材料则处于逐渐接近底面、三角形纯杂化碳键图的上部,处于由黑粗线所包围的有一定厚度的阴影三角形内。
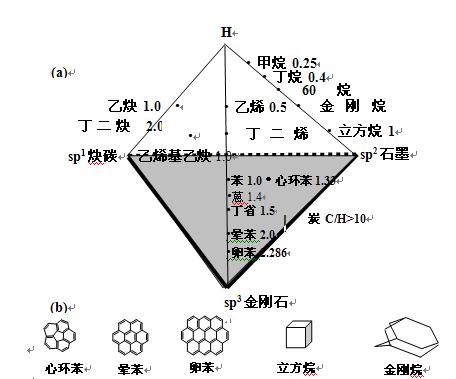
图2. 碳和炭的正四面体相图(a)和有关烃类的分子构型(b)
从这一立体图可看出各种有机烃类向炭(C/H>10)和纯粹碳物质的转化,如经甲烷、60烷、金刚烷和立方烷向金刚石的变化;经乙烯、丁二烯、苯、丁省、晕苯和卵苯向石墨的变化;经乙炔和丁二炔向卡宾的变化等。
碳原子的特异性使得碳的同素异形体如同碳的化合物一样,多种多样、无穷无尽,其性能也千变万化。每一次新的碳同素异形体的发现,均带动和开拓出无数研究和开发应用的新领域。今后各种碳的同素异形体有可能和碳所形成的各种有机化合物一样,在无机材料方面发挥出其独特而重要的作用,加强对新型碳同素异形体的研究,必将大大推动“材料碳”在新材料领域的开发和应用,也必将给我们带来更多新的惊喜!

